- Institute
-
Cardiovascular Physiology
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- and Sensory Physiology
- Teaching
- Central Facilities
- Bernard Katz Lecture
- Open Positions
- News
Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
Aus präklinischen Studien ist bekannt, dass die Abnahme des Sauerstoffpartialdruckes im ZNS bei zerebraler Ischämie nicht nur schadet, sondern parallel auch diverse adaptive Prozesse einleitet, die einerseits den akuten neuronalen Zelltod abmildern und andererseits zur langfristigen Neuroregeneration beitragen. Zahlreiche Schlüsselfaktoren, die jene adaptiven Prozesse mutmaßlich anstoßen, sind Zielgene der Hypoxie-induzierbaren Transkriptionsfaktoren (HIFs).
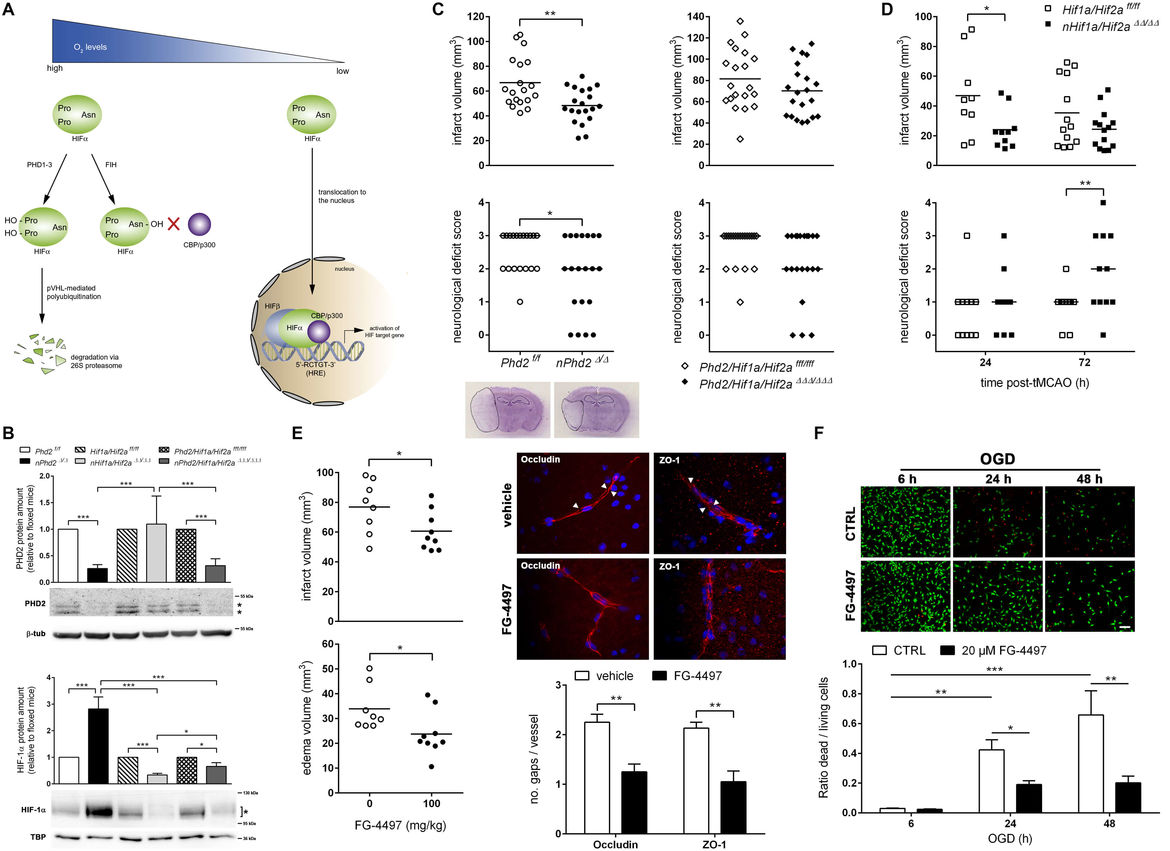
Ihre Aktivität wird in Abhängigkeit von der intrazellulären Sauerstoffkonzentration durch die Familie der Prolyl-4-Hydroxylase Domäne (PHD) Enzyme negativ reguliert (A). Ziel dieses Projekts ist es, durch Einsatz verschiedener transgener Mauslinien, die eine zielgerichtete und zellspezifische Ausschaltung der einzelnen Stellglieder der PHD-HIF-Achse ermöglichen, die relative Bedeutung des HIF-Signalwegs für die Aktivierung von endogenen protektiven und regenerativen Mechanismen im ischämiegeschädigten Gehirn zu evaluieren (B-D). Im Sinne eines translationalen Ansatzes untersuchen wir im murinen Schlaganfallmodell darüber hinaus, ob die systemische bzw. topische Anwendung von pharmakologischen Wirkstoffen, die durch spezifische Inhibition der PHD Enzyme den HIF-Signalweg gezielt aktivieren, zerebrale Gewebeschäden und sensomotorische Einschränkungen zu reduzieren vermag (E, F). Weiterführende komplementäre Analysen in kultivierten primären Gehirnzellen sollen helfen zugrundeliegende mechanistische Zusammenhänge aufzuklären.
Einfluss der genetischen und pharmakologischen Modulation des HIF-Signalweges auf den akuten Krankheitsverlauf beim ischämischen Schlaganfall. (A) Schema zur sauerstoffabhängigen Regulation des HIF-Signalweges (modifiziert nach Chan et al., Mol Aspects Med, 2016). (B) Der neuronenspezifische Knockout des HIF Suppressors PHD2 aktiviert den HIF-Signalweg im murinen Gehirn. (C) PHD2 defiziente Mäuse weisen nach akutem Schlaganfall eine verminderte Gewebsschädigung sowie reduzierte funktionelle Einschränkungen auf. Der verbesserte Outcome nach Schlaganfall basiert in erster Linie auf der Aktivierung von HIF-abhängigen Mechanismen. (D) Die neuronale Genablation von HIF-alpha verstärkt den zerebralen Gewebeschaden und die sensomotorischen Störungen in der subakuten Phase nach Schlaganfall. (E) Die systemische Applikation des pharmakologischen PHD Hemmstoffes FG-4497 in Mäusen führt zu einem kleineren Infarkt und vasogenen Hirnödem nach akutem Schlaganfall. Letzteres ist mit einem weniger starken Ischämie-bedingtem Integritätsverlust der Blut-Hirn-Schranke assoziiert. (F) Die Behandlung mit FG-4497 vermindert den Zelltod von Nervenzellen unter ischämischen Stressbedingungen in vitro.
Abbildung verändert nach Kunze et al., Stroke, 2012; Reischl et al., PLoS One, 2014; Barteczek et al., J Cereb Blood Flow Metab, 2017; Nasyrov et al., FASEB J, 2019.
.
- Institute
-
Cardiovascular Physiology
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- and Sensory Physiology
- Teaching
- Central Facilities
- Bernard Katz Lecture
- Open Positions
- News



![[Translate to English:] [Translate to English:]](/fileadmin/_processed_/9/b/csm_Firefly_Abstract_organic_flow_resembling_blood_vessels_shaped_as_a_tool__composed_of_glowing_651800_26778ea790.png)