- Institute
-
Cardiovascular Physiology
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- and Sensory Physiology
- Teaching
- Central Facilities
- Bernard Katz Lecture
- Open Positions
- News
Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
In Analogie zu HIF, der als Schlüsselregulator die genomische Antwort von Zellen auf Sauerstoffmangel vermittelt, gibt es mit NRF2 (nuclear factor-erythroid 2-related factor 2) einen weiteren Transkriptionsfaktor, der spezifisch durch oxidativen Stress, einem bedeutenden Trigger für neuronalen Zelltod und Dysfunktion in der Pathogenese des Schlaganfalls, aktiviert wird und dessen zahlreiche Zielgene antioxidative Wirkungen haben.
Unter physiologischen Bedingungen wird im Zytoplasma frei vorliegendes NRF2 von KEAP1 (Kelch-like ECH-associated protein 1) gebunden und dem proteasomalen Abbau zugeführt. Kommt es intrazellulär zu einem Überschuss oxidativ wirkender Verbindungen, führen diese zu spezifischen strukturellen Veränderungen in KEAP1, welche die Freisetzung und Stabilisierung von NRF2 begünstigen. In der Folge wandert NRF2 in den Zellkern und initiiert die Expression der NRF2-responsiven Zielgene. Es ist bekannt, dass Dimethylfumarat (DMF), ein Derivat der Fumarsäure, über denselben molekularen Mechanismus an KEAP1 angreift und so zur Freisetzung und Stabilisierung von NRF2 beiträgt. In diesem Projekt soll daher das therapeutische Potenzial von DMF für die Akutbehandlung des Schlaganfalls im Mausmodell untersucht werden. Um die tatsächliche Bedeutung von NRF2-abhängigen antioxidativen Prozessen für eine mögliche Schutzwirkung von DMF bei zerebraler Ischämie abschätzen zu können, sollen zum einen konditionale NRF2 Knockout-Mäuse zum Einsatz kommen und zum anderen reaktive Sauerstoffspezies (ROS), endogene antioxidative Schutzsysteme sowie ROS-bedingte Schädigungen molekularer Zielstrukturen im infarzierten Gehirn quantitativ erfasst werden.
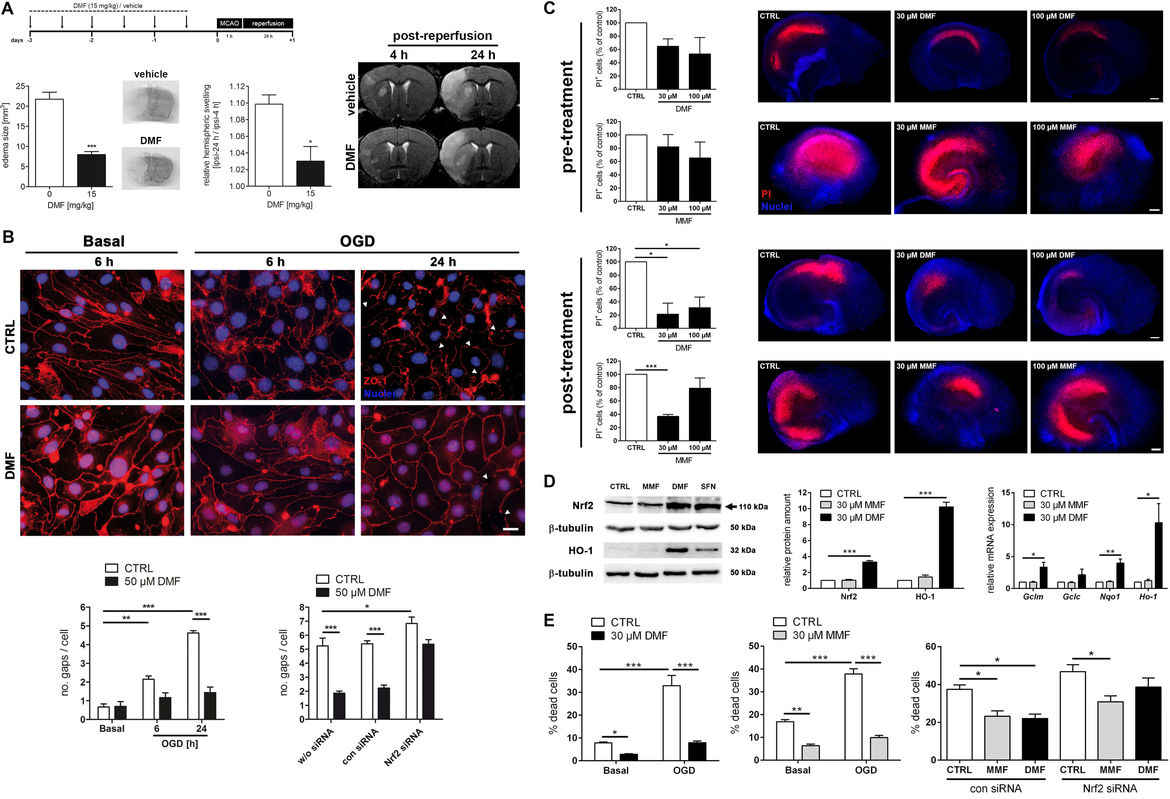
Einfluss der pharmakologischen Modulation des NRF2-Signalweges auf den akuten Krankheitsverlauf beim ischämischen Schlaganfall. (A) Die systemische Applikation von DMF führt in Mäusen zu einem verminderten vasogenen Hirnödem nach akutem Schlaganfall. (B) Die Behandlung von murinen zerebralen Endothelzellen mit DMF stabilisiert die interendothelialen Zellkontakte unter ischämischen Stressbedingungen in vitro in NRF2-abhängiger Weise. (C) Der ischämiebedingte neuronale Zelltod in ex vivo organotypischen Hippocampuskulturen wird durch die post-ischämische Behandlung mit den Fumarsäureestern DMF und Monomethylfumarat (MMF) reduziert. (D) In neuronalen Zellkulturen erhöht DMF die Proteinstabilität von NRF2 und steigert die Expression von NRF2-abhängigen Zielgenen mit antioxidativer Wirkung. (E) DMF und MMF vermindern den Zelltod von Nervenzellen unter ischämischen Stressbedingungen in vitro in NRF2-abhängiger bzw. -unabhängiger Weise.
Abbildung verändert nach Kunze et al., Exp Neurol, 2015; Lin-Holderer et al., Neuropharmacology, 2016.
- Institute
-
Cardiovascular Physiology
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- and Sensory Physiology
- Teaching
- Central Facilities
- Bernard Katz Lecture
- Open Positions
- News



![[Translate to English:] [Translate to English:]](/fileadmin/_processed_/9/b/csm_Firefly_Abstract_organic_flow_resembling_blood_vessels_shaped_as_a_tool__composed_of_glowing_651800_26778ea790.png)
