- Institut
-
Herz- und Kreislaufphysiologie
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- und Sinnesphysiologie
- Lehre
- Zentrale Einrichtungen
- Bernard Katz Lecture
- Stellenangebote
- Aktuelles
Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
Erkrankungen des ZNS werden typischerweise von lokalen inflammatorischen Prozessen begleitet, die den Krankheitsverlauf wesentlich beeinflussen und mit dem Ausmaß von krankheitsbedingten kognitiven, sensorischen und/oder motorischen Einschränkungen korrelieren.
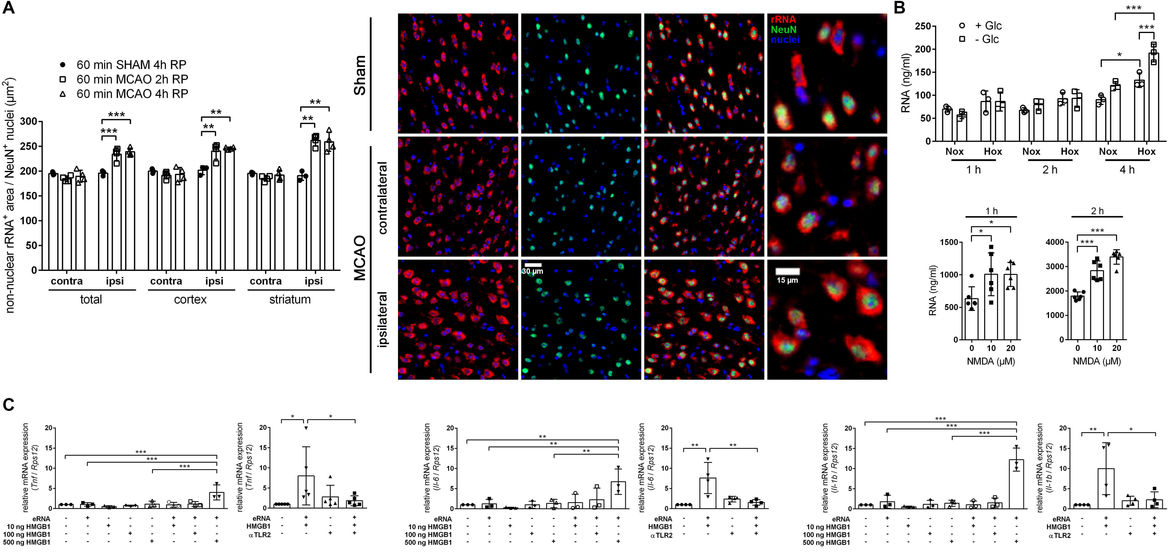
Die Schädigung von Zellen im ZNS führt zur Freisetzung von sog. Alarminen (DAMPs, damage-associated molecular patterns), einer strukturell heterogenen Gruppe von endogenen Molekülen (v.a. Proteine, Nukleinsäuren), die residente immunkompetente Zellen (Mikroglia, Astrozyten) sowie aus der Peripherie in das Gehirn eingewanderte Immunzellen aktivieren und somit den Inflammationsprozess im erkrankten ZNS initiieren bzw. verstärken. In diesem Kontext zeigen unsere Untersuchungen, dass Neurone unter zerebraler Ischämie in vivo ribosomale RNA freisetzen (A). Komplementär durchgeführte Analysen in in vitro kultivierten primären Nervenzellen bestätigen, dass Mangelzustände (z.B. Sauerstoffmangel) bzw. pathologische Prozesse (z.B. Glutamat-induzierte Exzitotoxizität), die im Rahmen eines ischämischen Schlaganfalls auftreten, sowohl die passive als auch aktive Freisetzung von zellulärer RNA stimulieren (B). Extrazelluläre RNA (exRNA) stimuliert die pro-inflammatorische Aktivierung von Astrozyten in vitro, indem sie als eine Art „Adjuvans“ das pro-inflammatorische Potenzial anderer Alarmine (z.B. HMGB1, High mobility group box protein 1) signifikant steigert (C). Wir vermuten, dass es sich hierbei um einen generellen Mechanismus handelt, der nicht nur die neuroinflammatorischen Prozesse nach ischämischem Schlaganfall begünstigt, sondern auch jene im Rahmen von chronisch degenerativen Erkrankungen des ZNS wie der Multiplen Sklerose (MS), Morbus Alzheimer (AD, Alzheimer's disease) oder Morbus Parkinson (PD, Parkinson's disease). Darüber hinaus liegt die Vermutung nahe, dass neben exRNA auch extrazelluläre DNA (exDNA) nukleären Ursprungs als pro-inflammatorisches Alarmin fungieren könnte. Das Hauptanliegen dieses Projektes ist es daher in geeigneten Tierkrankheitsmodellen zu überprüfen, ob die intrazerebrale Applikation von RNase1 oder DNase bzw. die gehirnspezifische Genablation von RNase1/DNase die krankheitsbedingten neuroinflammatorischen Prozesse und die damit verbundenen funktionellen Einschränkungen entsprechend gegensinnig modulieren.
Extrazelluläre RNA stimuliert die pro-inflammatorische Aktivierung von Astrozyten. (A) Zerebrale Ischämie in vivo bedingt die vermehrte Freisetzung von ribosomaler RNA durch Neurone. (B) Sauerstoffmangel und Glutamat-induzierte Exzitotoxizität stimulieren die Freisetzung von zellulärer RNA in in vitro kultivierten primären Nervenzellen. (C) Extrazelluläre RNA fungiert als Kofaktor für die pro-inflammatorische Aktivierung von Astrozyten durch das Alarmin HMGB1.
Abbildung verändert nach Fischer et al., J Neuroinflammation, 2021.
- Institut
-
Herz- und Kreislaufphysiologie
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- und Sinnesphysiologie
- Lehre
- Zentrale Einrichtungen
- Bernard Katz Lecture
- Stellenangebote
- Aktuelles