- Institut
-
Herz- und Kreislaufphysiologie
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- und Sinnesphysiologie
- Lehre
- Zentrale Einrichtungen
- Bernard Katz Lecture
- Stellenangebote
- Aktuelles
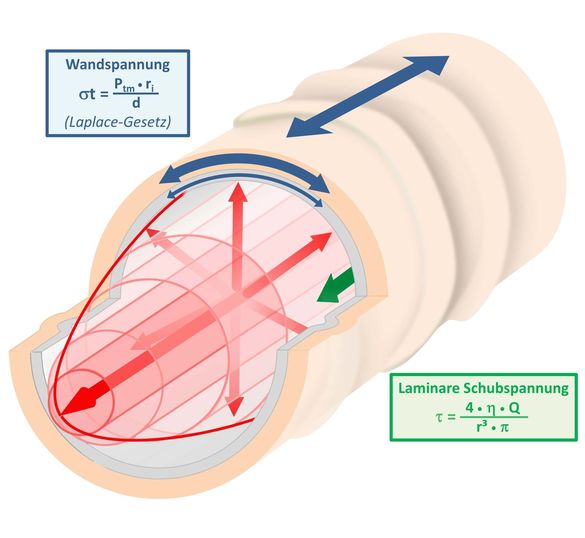
Hintergrund: Biomechanische Kräfte im Gefäßsystem
Im Blutgefäß spielen mechanische Reize, vor allem bedingt durch die auf Endothelzellen einwirkende unidirektionale Schubspannung und die Wandspannung, die sowohl Endothel- als auch glatte Muskelzellen beeinflusst, eine wichtige Rolle bei der Regulation des Blutflusses und der dauerhaften Homöostase des Gefäßsystems.
Primäre Kräfte, die Gefäßtonus und vaskuläre Homöostase modulieren. Während die unidirektionale Schubspannung (τ) durch Blut-Viskosität (η), laminare Strömung (Q) und den Kehrwert des Gefäßradius (r) definiert wird, hängt die Wandspannung vom transmuralen Druck (Ptm), Radius (r) und Kehrwert der Wanddicke des Gefäßes (d) ab.
nach Pfisterer L et al. Pathogenesis of varicose veins - lessons from biomechanics. Vasa. 2014 March;43(2):88-99.
Da beide Kräfte entgegengesetzt vom Gefäßdurchmesser abhängen, regulieren sie den Gefäßtonus und damit den Blutfluss als Antagonisten. Dies ist bis in die molekularen Mechanismen gut untersucht, die z. B. auf Stickstoffmonoxid (NO) und dem gefäßverengenden Peptid Endothelin-1 basieren. Aber obwohl die langfristigen Auswirkungen einer veränderten Schub- und Wandspannung, wie sie z. B. bei der druckinduzierten arteriellen Hypertrophie/Hyperplasie bei Patienten mit Bluthochdruck zu beobachten sind, auf die Struktur der Gefäßwande gut dokumentiert sind, sind die Signalwege, die diesen Prozessen zugrunde liegen, noch nicht genauer charakterisiert. Unsere Gruppe konzentriert sich auf zwei Projekte, um die Auswirkungen von Wandspannung und unidirektionaler Schubspannung auf die Genexpression und Regulation des Phänotyps der Endothel- und glatten Muskelzellen zu analysieren.
- Institut
-
Herz- und Kreislaufphysiologie
- Markus Hecker
- Thomas Korff
-
Hugo H. Marti
-
Forschung
- Zelluläre und molekulare Mechanismen der postnatalen Entwicklung des zerebralen Gefäßsystems
- Die Bedeutung der molekularen PHD-HIF Achse für den akuten Schutz und die langfristige Regeneration nach einem ischämischen Schlaganfall
- Charakterisierung und gezielte Aktivierung von NRF2-abhängigen antioxidativen Mechanismen beim akuten Schlaganfall
- Extrazelluläre Nukleinsäuren als Trigger neuroinflammatorischer Prozesse in akuten und chronisch degenerativen Erkrankungen des Zentralnervensystems
- Neuroprotektion und Neurogenese
- Blut-Hirn-Schranke
- Publikationen
- Personal
-
Forschung
- Andreas H. Wagner
- Neuro- und Sinnesphysiologie
- Lehre
- Zentrale Einrichtungen
- Bernard Katz Lecture
- Stellenangebote
- Aktuelles